中国北大教授找出治愈艾滋病和白血病新办法
艾滋病检测中心2019-10-28
北大教授邓宏魁把基因编辑变成了可以治疗艾滋病的工具。从实验到临床、从原理到实践,数年的努力后,世界首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例初步报道。
邓宏魁课题组对运用基因编辑技术治疗白血病、艾滋病等血液系统相关疾病的临床治疗持审慎乐观态度。未来的研究领域将着重于基因编辑效率和临床应用安全。
对免疫系统“精确制导”的HIV
自二十世纪八十年代以来,艾滋病造成了重大的公共卫生问题和社会问题。这是一种让人谈之色变的病毒型传染病,艾滋病毒通过破坏T细胞,能削弱机体抗感染和癌症的防御功能,患者多死于严重感染和癌症。
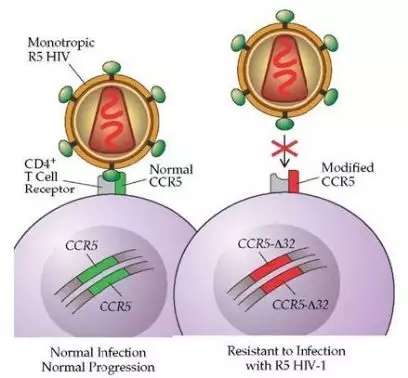
艾滋病之所以成为人类健康的“杀手”,是因为HIV病毒会识别并摧毁人体T细胞。而病毒是怎么“认出”T细胞的呢?不是因为它“看得到”,而是由于T细胞表面“特异性受体”的存在。
1996年,艾滋病研究领域取得了里程碑式进展:HIV病毒入侵T细胞的主要共受体CCR5被发现(邓宏魁教授是主要发现者之一)。艾滋病病毒表面的某种蛋白会与CD4阳性T细胞表面的受体结合,在CCR5的帮助下,实现对免疫系统的破坏。
“柏林病人”和“伦敦病人”的提示
那么,如果少了CCR5的帮助,是不是就能阻止HIV的肆虐呢?事实正是如此。随后的研究发现,CCR5-Δ32纯合突变的CD4阳性T细胞具有抵御HIV感染的能力。这一基因突变后,免疫细胞表面的CCR5受体就会发生变化,艾滋病病毒表面的某种蛋白与CD4阳性T细胞表面的受体结合就无法照常进行了。

